Siapa sangka, di balik nama keren 'HCl', tersembunyi senyawa hidroklorida yang terbentuk dari duet maut atom hidrogen (H) dan klorin (Cl) dengan ikatan kovalen yang solid. Dijamin, HCl ini bintangnya kimia anorganik, lho! Sering nongol di industri dan lab, dia selalu punya peran penting.
Lambang buat senyawa ini ya HCl itu sendiri. Huruf 'H' itu singkatan buat atom hidrogen, dan 'Cl' itu buat atom klorin. Kalo di kimia, lambang unsur itu biasanya satu atau dua huruf, terus huruf pertamanya pake kapital. Nah, dari lambang HCl ini, kita tahu kalau dia itu gabungan satu atom hidrogen (H) sama satu atom klorin (Cl) yang saling nyambung.
Senyawa HCl ini punya ikatan kovalen polar. Ikatan kovalen itu kejadiannya pas dua atom, yaitu hidrogen (H) sama klorin (Cl), saling bagi-bagi elektron biar stabil. Nah, di HCl ini, elektronnya dibagiinnya gak rata lho. Si klorin lebih kuat narik elektron daripada hidrogen. Makanya, jadilah ikatan kovalen polar, di mana atom klorinnya dapet muatan negatif sebagian (δ-) dan hidrogennya dapet muatan positif sebagian (δ+).
Bayangkan saja, saat HCl (atau si asam klorida) berjumpa air, terjadilah drama perpisahan! Dia langsung pecah jadi dua kubu: ion H+ yang 'merdeka' dan ion Cl- yang setia menemani klorin. Proses dramatis ini dikenal sebagai ionisasi atau disosiasi elektrolitik. Hasilnya? Larutan asam klorida yang penuh ion H+ dan Cl- bebas berkeliaran, siap mengantarkan listrik dan menciptakan suasana asam yang khas!
Ini dia beberapa sifat fisiknya HCl:
- Bentuk: HCl merupakan gas pada suhu kamar & tekanan atmosfer. Namun, HCl juga dapat dihasilkan dalam bentuk larutan yg dikenal sebagai asam klorida.
- Bau: HCl mempunyai bau yg tajam, asam, & mengganggu.
- Kelarutan: HCl mudah larut dalam air, menghasilkan larutan asam yg kuat.
Nah, kalo ini sifat-sifat kimianya HCl:
- Keasaman: HCl merupakan asam kuat & dapat mengionisasi sepenuhnya ketika dilarutkan dalam air. Ion hidrogen (H+) dilepaskan oleh HCl, sehingga larutan HCl mempunyai pH yg rendah & bersifat asam.
- Reaksi dengan logam: HCl bereaksi dengan banyak logam, seperti seng (Zn) maupun besi (Fe), menghasilkan garam klorida & gas hidrogen (H2). Contoh reaksi: 2HCl + Zn -dangt; ZnCl2 + H2
- Reaksi dengan basa: HCl bereaksi dengan basa membentuk garam & air. Ini merupakan reaksi netralisasi. Contoh reaksi: HCl + NaOH -dangt; NaCl + H2O
- Reaksi dengan batuan karbonat: HCl bereaksi dengan batuan karbonat, seperti kalsium karbonat (CaCO3), menghasilkan garam klorida, air, & gas karbon dioksida (CO2). Contoh reaksi: 2HCl + CaCO3 -dangt; CaCl2 + CO2 + H2O
HCl ini biasanya dipakai buat apa aja, ya?
- Industri kimia: HCl digunakan dalam produksi berbagai senyawa kimia, seperti PVC (polivinil klorida), poliuretan, & bahan kimia lainnya.
- Industri pembersihan: HCl digunakan dalam produk pembersih rumah tangga & komersial untuk menghilangkan noda & kerak pada permukaan.
- Industri petrokimia: HCl digunakan dalam proses pemurnian minyak bumi & produksi bahan kimia berbasis minyak.
- Laboratorium: HCl digunakan dalam laboratorium untuk analisis kimia, pengaturan pH, & reagen dalam berbagai percobaan.
Eits, jangan sampai terlena dengan kehebatannya! Ingat, HCl ini si 'nakal' yang korosif dan berbahaya. Jadi, kalau berurusan dengannya, pastikan pakai baju perang lengkap (APD) dan ikuti semua aturan main keamanannya. Keselamatan nomor satu, ya!
Sejarah Senyawa HCL

Penasaran bagaimana HCl bisa jadi legenda? Ternyata, kisahnya erat kaitannya dengan petualangan perkembangan kimia dan penemuan elemen-elemen di tabel periodik. Yuk, intip highlight penting dari sejarah sang asam klorida ini!
- Penemuan Hidrogen: Hidrogen (H) diidentifikasi sebagai unsur pada akhir abad ke-18 oleh ilmuwan Inggris Henry Cavendish pada tahun 1766. Ia mengamati bahwa ketika logam magnesium bereaksi dengan asam, gas yg dihasilkan membentuk ledakan jika terkena percikan api. Cavendish menyimpulkan bahwa gas tersebut merupakan sebuah unsur baru yg ia sebut “inflammable air” (udara yg mudah terbakar), yg sekarang dikenal sebagai hidrogen.
- Penemuan Klorin: Klorin (Cl) ditemukan oleh ahli kimia Swedia, Carl Wilhelm Scheele, pada tahun 1774. Ia menghasilkan klorin dengan mereaksikan asam klorida (HCl) dengan zat pengoksidasi seperti asam nitrat. Namun, Scheele tidak menyadari bahwa klorin merupakan unsur yg berbeda & menganggapnya sebagai varian oksigen.
- Identifikasi Senyawa HCl: Pada awal abad ke-19, ilmuwan Prancis Joseph-Louis Gay-Lussac & ahli kimia Inggris Humphry Davy memainkan peran penting dalam memahami senyawa HCl. Pada tahun 1809, Gay-Lussac menyelidiki sifat-sifat gas hidrogen klorida & menentukan komposisinya. Dia menemukan bahwa HCl terdiri dari hidrogen & suatu unsur yg disebut klorin.
- Pendekatan Teoritis: Ahli kimia Jerman, Justus von Liebig & Friedrich Wöhler, mengembangkan teori elektrolit & menunjukkan bahwa asam klorida (HCl) terionisasi sepenuhnya dalam larutan air, membebaskan ion hidrogen (H+) & ion klorida (Cl-). Pemahaman ini penting untuk memahami sifat asam & basa serta reaksi kimia yg melibatkan HCl.
- Penggunaan Industri: Penggunaan industri HCl mulai berkembang pada abad ke-19. Senyawa ini digunakan dalam proses pengolahan makanan, pembuatan kertas, pemrosesan logam, pengolahan limbah, & produksi berbagai bahan kimia.
Sejak pertama kali ditemukan dan dipahami, HCl tak pernah berhenti bikin ilmuwan penasaran! Penelitian terus bergulir, mengungkap lebih banyak rahasia sifat dan reaksinya. Hingga kini, sang asam klorida tetap eksis sebagai bahan kimia krusial di berbagai industri dan aplikasi, tak lekang oleh waktu!
Sifat Senyawa HCL
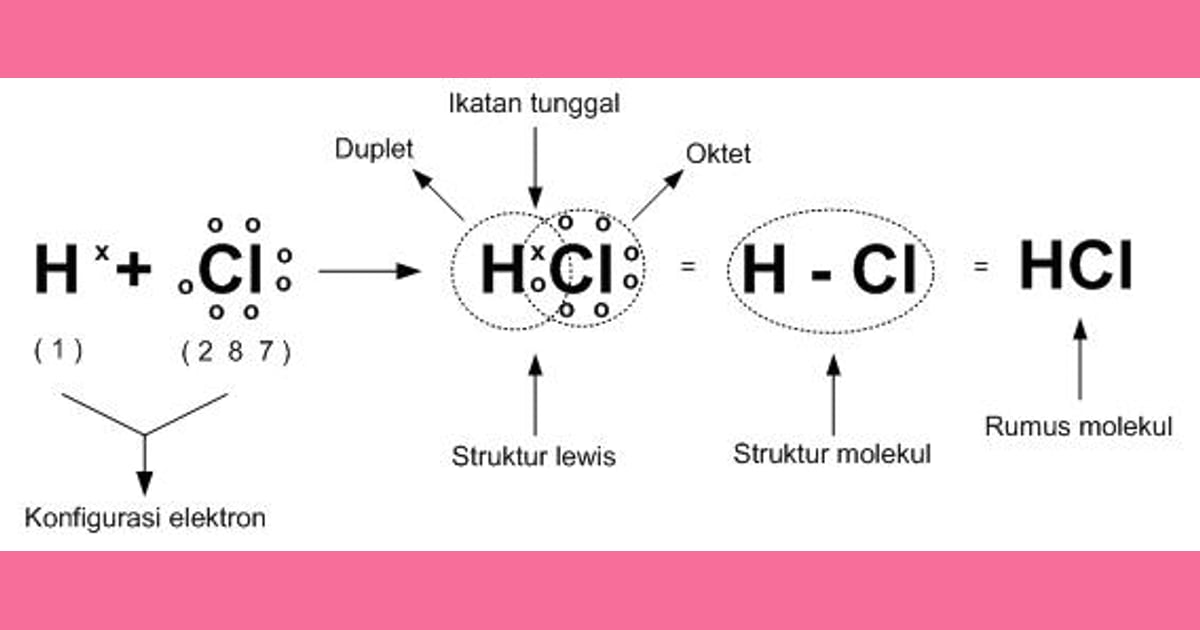
Senyawa HCl atau asam klorida ini punya beberapa sifat yang penting banget lho:
- Keasaman: HCl merupakan asam kuat. Ketika dilarutkan dalam air, HCl mengionisasi sepenuhnya menjadi ion hidrogen (H+) & ion klorida (Cl-). Kehadiran ion hidrogen dalam larutan membuat HCl mempunyai pH yg rendah, menunjukkan sifat asam yg kuat.
- Reaktivitas: HCl merupakan senyawa yg sangat reaktif. Hal ini disebabkan oleh ikatan kovalen polar antara atom hidrogen & atom klorin, yg memungkinkan pembentukan muatan parsial positif (δ+) pada atom hidrogen & muatan parsial negatif (δ-) pada atom klorin. Sifat polar ini memungkinkan HCl untuk berpartisipasi dalam berbagai reaksi kimia, seperti reaksi asam-basa, reaksi dengan logam, & reaksi dengan batuan karbonat.
- Larut dalam air: HCl sangat larut dalam air, menghasilkan larutan asam yg kuat. Ketika HCl dilarutkan dalam air, ion hidrogen (H+) & ion klorida (Cl-) terdispersi dalam larutan. Larutan HCl mempunyai sifat konduktif karena adanya ion-ion yg bergerak bebas di dalamnya.
- Bau yg tajam: HCl mempunyai bau yg tajam, asam, & mengganggu. Bau ini disebabkan oleh reaksi HCl dengan zat-zat dalam lingkungan, seperti air maupun udara, yg menghasilkan senyawa-senyawa volatil.
- Korosif: HCl merupakan senyawa yg sangat korosif & dapat menyebabkan kerusakan pada bahan-bahan yg sensitif terhadap asam. Kontak dengan HCl dalam bentuk cair maupun uap dapat menyebabkan iritasi pada kulit, mata, & saluran pernapasan.
Intinya, saat beraksi dengan HCl, jangan pernah lengah! Patuhi setiap prosedur keamanan, pakai perlengkapan perang lengkap seperti sarung tangan, kacamata pelindung, dan baju khusus. Ingat, ini bukan sekadar gaya, tapi demi keselamatan Anda!
Karakteristik Senyawa HCL

Penasaran dengan 'profil' lengkap HCl? Ini dia beberapa karakteristik menarik dari asam klorida yang kami sajikan dalam bentuk tabel, siap untuk Anda bedah!
| Karakteristik | Deskripsi |
|---|---|
| Nama | Asam klorida |
| Rumus Kimia | HCl |
| Massa Molekul | Sekitar 36,46 g/mol |
| Fase pada Suhu Kamar | Gas |
| Warna | Tidak berwarna |
| Bau | Bau yg tajam, asam, & mengganggu |
| Kelarutan dalam Air | Sangat larut |
| Keasaman | Asam kuat |
| Ionisasi | HCl mengionisasi sepenuhnya menjadi ion H+ & ion Cl- |
| Sifat Reaktif | Reaktif & dapat berpartisipasi dalam berbagai reaksi kimia |
| Penggunaan | Industri kimia, pembersihan, pengolahan makanan, laboratorium |
| Keberadaan Alami | Tidak ditemukan secara alami dalam bentuk murni |
| Sifat Korosif | Sangat korosif & dapat menyebabkan kerusakan pada bahan-bahan |
Tabel di atas memberikan gambaran umum tentang karakteristik senyawa HCl dalam bentuk yg terstruktur & tercetak. Harap diingat bahwa beberapa informasi, seperti kelarutan dalam air, keasaman, & penggunaan, telah dijelaskan sebelumnya & hanya diperbarui dalam tabel ini untuk kejelasan.
Karakteristik HCl (asam klorida) itu antara lain:
- Sifat fisik:
- Fase: HCl merupakan gas pada suhu kamar & tekanan atmosfer. Namun, HCl juga dapat berada dalam bentuk larutan asam klorida.
- Bau: HCl mempunyai bau yg tajam, asam, & mengganggu.
- Warna: HCl dalam bentuk gas tidak mempunyai warna, sedangkan larutan asam klorida dapat berwarna bening hingga kuning pucat.
- Sifat kimia:
- Keasaman: HCl merupakan asam kuat yg mengionisasi sepenuhnya dalam air, melepaskan ion hidrogen (H+) yg memberikan sifat asam.
- Reaktivitas: HCl merupakan senyawa yg reaktif & dapat berpartisipasi dalam berbagai reaksi kimia. Ini termasuk reaksi dengan logam, batuan karbonat, basa, & berbagai senyawa organik.
- Larut dalam air: HCl sangat larut dalam air, membentuk larutan asam yg kuat. Ketika HCl dilarutkan dalam air, molekulnya terionisasi menjadi ion H+ & Cl-.
- Keberadaan alami:
- HCl tidak ditemukan secara alami dalam bentuk murni di alam. Namun, asam klorida dapat terbentuk melalui proses alami, seperti reaksi gas klorin dengan air laut maupun reaksi gas klorin dengan bahan-bahan organik dalam lingkungan.
- Keberadaan dalam industri & laboratorium:
- HCl digunakan secara luas dalam berbagai industri, seperti industri kimia, petrokimia, pengolahan makanan, & pembersihan.
- HCl juga digunakan sebagai reagen dalam laboratorium untuk analisis kimia, penyesuaian pH, & reaksi kimia lainnya.
- Sifat korosif:
- HCl merupakan senyawa yg sangat korosif & dapat menyebabkan kerusakan pada bahan sensitif terhadap asam. Kontak langsung dengan HCl dapat menyebabkan iritasi pada kulit, mata, & saluran pernapasan.
Peringatan keras! Mengingat HCl adalah zat yang super korosif dan berbahaya, jangan pernah coba-coba menantangnya tanpa persiapan. Selalu patuhi prosedur keamanan dan kenakan APD yang lengkap. Ingat, lebih baik aman daripada menyesal!
Gaya Pada Senyawa HCL
Gaya-gaya yang ada di HCl itu adalah gaya ikatan kovalen polar antara atom hidrogen (H) sama atom klorin (Cl), terus ada juga gaya antarmolekul di antara molekul-molekul HCl itu sendiri.
- Gaya ikatan kovalen polar: Gaya ini terjadi karena adanya elektron pasangan yg terbagi secara tidak merata antara atom H & atom Cl. Karena klorin lebih elektronegatif daripada hidrogen, atom Cl menarik pasangan elektron lebih kuat, sehingga memperoleh muatan parsial negatif (δ-) & atom H memperoleh muatan parsial positif (δ+). Gaya ikatan kovalen polar ini menyebabkan molekul HCl mempunyai momen dipol.
- Gaya antarmolekul: Gaya antarmolekul terjadi antara molekul-molekul HCl di dalam senyawa. Gaya-gaya ini meliputi gaya tarik-menarik antara momen dipol positif (atom H yg bermuatan parsial positif) molekul HCl dengan momen dipol negatif (atom Cl yg bermuatan parsial negatif) molekul HCl yg berdekatan. Gaya antarmolekul ini juga berperan dalam menentukan sifat fisik senyawa, seperti titik didih & kelarutan.
Berkat dua 'kekuatan super' ini—ikatan kovalen polar dan gaya antarmolekul—HCl menjelma menjadi senyawa dengan sifat-sifat unik: sangat asam, mudah larut dalam air, dan tentu saja, molekulnya yang polar abis!
Kegunaan & Jenis gugus Fungsi Senyawa HCL
HCl, atau sering juga disebut asam klorida, punya banyak banget kegunaan di industri dan lab. Ini nih beberapa contoh kegunaannya:
- Industri kimia: HCl digunakan dalam produksi berbagai senyawa kimia, seperti PVC (polivinil klorida), poliuretan, tawas, & bahan kimia lainnya.
- Industri pembersihan: HCl digunakan dalam produk pembersih rumah tangga & komersial untuk menghilangkan noda & kerak pada permukaan, termasuk di dapur, kamar mandi, & toilet.
- Industri petrokimia: HCl digunakan dalam proses pemurnian minyak bumi & produksi bahan kimia berbasis minyak, seperti alkil klorida.
- Pengolahan makanan: HCl digunakan dalam industri pengolahan makanan sebagai bahan tambahan dalam pemrosesan & pengawetan makanan.
- Laboratorium: HCl digunakan dalam laboratorium sebagai reagen dalam berbagai analisis kimia, penyesuaian pH, & reaksi kimia lainnya.
Mari berkenalan dengan 'jantung' HCl: gugus asam klorida! Inilah tempat atom klorin 'berpegangan tangan' erat dengan atom hidrogen melalui ikatan kovalen polar. Gugus inilah yang menjadikan HCl primadona di dunia kimia organik sebagai asam kuat, siap bereaksi dengan semangat membara!
Referensi
Ini dia beberapa sumber yang bisa kamu pakai kalo mau belajar lebih banyak tentang HCl (asam klorida) dan topik-topik seputar itu:
- Buku Teks Kimia:
- “Chemistry: The Central Science” oleh Theodore L. Brown, H. Eugene LeMay, et al.
- “Principles of Modern Chemistry” oleh David W. Oxtoby, H. Pat Gillis, et al.
- “Inorganic Chemistry” oleh Gary L. Miessler, Paul J. Fischer, et al.
- Jurnal & Artikel Ilmiah:
- Journal of the American Chemical Society (JACS)
- Journal of Physical Chemistry (JPC)
- Inorganic Chemistry
- Chemical Reviews
- Journal of Chemical Education
- Sumber Online:
- PubChem
- Royal Society of Chemistry (RSC)
- American Chemical Society (ACS)
Pastikan kamu nyari info yang sesuai sama topik yang lagi kamu tertarik, misalnya sifat fisik dan kimia HCl, gimana dia dipake di industri, atau reaksi-reaksi kimianya. Dan yang paling penting, selalu cek sumbernya yang terpercaya ya!