Coba tebak, apa sih senyawa basa itu? Gampangnya, dia itu agen rahasia kimia yang suka banget ngeluarin 'kartu AS' berupa ion hidroksida (OH-) pas lagi berenang di air. Nah, si OH- inilah biang keladinya kenapa dia jadi si 'basa' yang jago netralisir!
Kebanyakan senyawa basa itu kayak tim duet maut: atom logam dan ion hidroksida. Begitu nyemplung air, mereka langsung 'pecah kongsi' jadi ion-ion terpisah. Contoh paling beken? Natrium hidroksida (NaOH) yang langsung bubar jadi Na+ dan OH- di dalam larutan, siap beraksi!
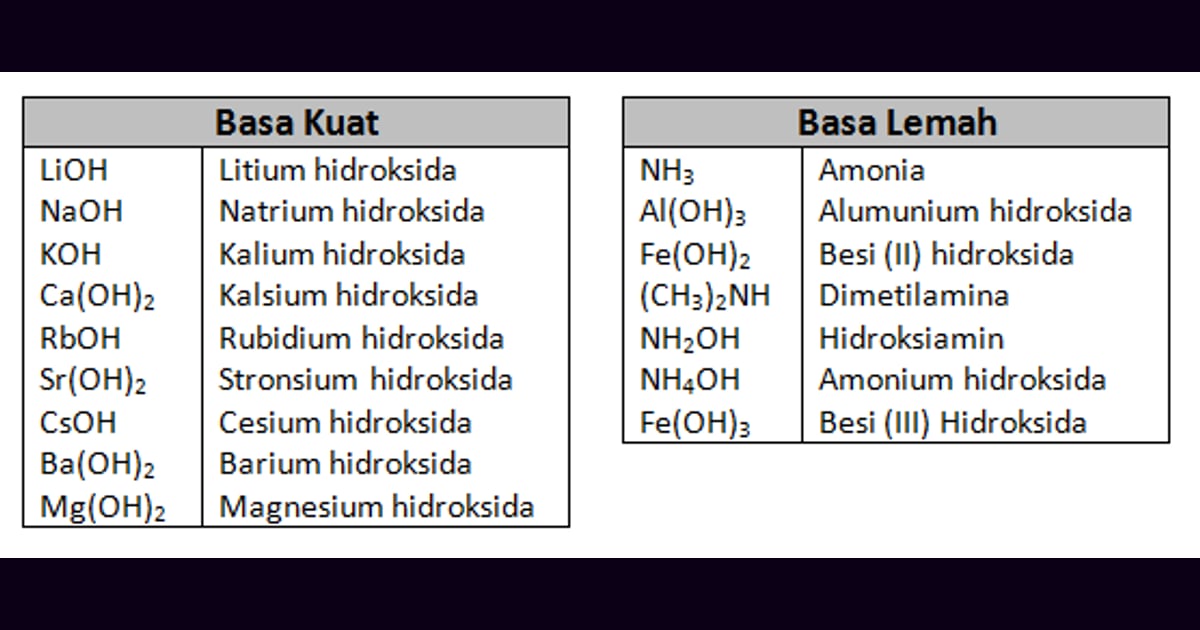
Penasaran sama geng basa yang sering nongol? Ada keluarga hidroksida logam alkali macam natrium hidroksida (NaOH) dan kalium hidroksida (KOH). Jangan lupakan juga sepupu mereka dari golongan alkali tanah, seperti kalsium hidroksida (Ca(OH)2) dan magnesium hidroksida (Mg(OH)2) – mereka juga jagoan basa, lho!
Tapi jangan kaget! Ternyata basa itu enggak melulu soal logam. Ada juga 'basa rebel' dari senyawa non-logam, contohnya amonia (NH3). Meski tanpa embel-embel logam, begitu ketemu air, dia langsung berubah jadi amonium hidroksida (NH4OH) dan tetap setia mengeluarkan ion hidroksida. Keren, kan?
Nah, ini dia beberapa sifat senyawa basa:
- Kemampuan untuk menghasilkan rasa pahit saat larutan basa dikonsumsi.
- Kemampuan untuk mengubah kertas lakmus merah menjadi biru. Lakmus merupakan indikator alami yg berubah warna dalam kehadiran basa maupun asam.
- Sifat netralisasi terhadap asam. Senyawa basa dapat bereaksi dengan asam membentuk garam & air dalam reaksi netralisasi.
Enggak cuma itu, senyawa basa juga bisa ikutan di reaksi kimia lain. Mereka bisa bikin kompleks sama logam atau jadi 'penghilang' asam di berbagai proses kimia.
Tapi perlu diingat ya, enggak semua senyawa yang punya oksigen (O) atau hidroksida (OH) itu pasti basa. Ada juga yang sifatnya netral atau malah asam, tergantung sama bagian lain di molekulnya.
Singkatnya, senyawa basa itu zat kimia yang ngeluarin ion hidroksida (OH-) pas larut di air dan punya sifat basa. Mereka bisa dari logam alkali, logam alkali tanah, logam transisi, logam tanah jarang, atau bahkan senyawa non-logam kayak amonia. Sifat-sifat basa itu antara lain rasanya pahit, bikin kertas lakmus biru, dan bisa netralin asam.
Sejarah Senyawa Basa
Kisah senyawa basa ini bagaikan sebuah petualangan seru dalam dunia kimia, dimulai dari saat manusia mulai mengintip dan memahami sifat-sifat misterius zat. Ini adalah cerita tentang penemuan, pemahaman mendalam, dan peran krusialnya dalam berbagai aplikasi serta reaksi kimia yang mengubah dunia!
Salah satu 'sesepuh' basa yang paling legendaris adalah kalsium hidroksida (Ca(OH)2), alias si kapur padam atau kapur sirih. Bayangkan, dari zaman baheula, kakek moyang kita sudah memanfaatkan kapur padam ini untuk segala rupa, mulai dari bahan bangunan, pengobatan tradisional, hingga industri. Multitalenta banget!
Di abad ke-8 Masehi, ada ilmuwan Muslim terkenal namanya Jabir bin Hayyan (Geber), yang dijuluki bapak kimia. Beliau punya peran gede banget dalam ngembangin kimia dan pengetahuan soal senyawa basa. Dia berhasil nemuin beberapa basa, termasuk natrium hidroksida (NaOH) dan kalium hidroksida (KOH).
Pemahaman kita sekarang tentang sifat basa itu berkembang di abad ke-18 dan ke-19 berkat beberapa ilmuwan top. Salah satunya ahli kimia Prancis, Antoine Lavoisier, yang punya peran penting di teori asam-basa. Dia ngasih definisi baru buat basa, yaitu zat yang bisa nerima proton (H+) di reaksi kimia.
Melompat ke abad ke-19, muncul pahlawan kimia dari Swedia, Svante Arrhenius! Beliau melahirkan teori disosiasi elektrolit yang revolusioner, mengungkap rahasia bagaimana senyawa basa 'bercerai' di larutan dan melepas ion hidroksida (OH-). Teori Arrhenius ini bagaikan kunci pembuka yang membuat kita bisa melihat gambaran besar sifat basa dan reaksi kimia dengan lebih jelas.
Terus, ada juga ilmuwan kayak Friedrich Kohlrausch dan Fritz Haber yang punya andil besar dalam ngembangin pemahaman tentang konduktivitas larutan basa. Ini ngebantu banget buat ngukur seberapa banyak ion hidroksida di larutan dan ngerti kekuatan basa.
Di abad ke-20, konsep asam-basa makin berkembang lagi dengan teori Brønsted-Lowry dan teori Lewis. Teori Brønsted-Lowry bilang asam itu pemberi proton dan basa itu penerima proton. Sedangkan teori Lewis ngejelasin basa itu penerima pasangan elektron dan asam itu pemberi pasangan elektron.
Syukurlah, berkat kemajuan teknologi dan ilmu kimia modern, kita kini bisa menciptakan dan memahami lebih banyak jenis senyawa basa. Mereka ini bukan sekadar zat biasa, tapi pahlawan tak terlihat yang berperan krusial di berbagai sektor, mulai dari industri kimia, farmasi, pengolahan air, dan seabrek bidang penting lainnya!
Singkatnya, perjalanan sejarah senyawa basa ini adalah epik tentang bagaimana pemahaman kita terhadap sifat-sifat zat terus berevolusi, diiringi penemuan-penemuan basa yang bisa kita rangkum dengan cara yang sangat menarik seperti ini:
- Abad ke-19:
- Pada tahun 1808, ahli kimia Inggris Humphry Davy berhasil mengisolasi logam alkali & alkali tanah, termasuk sodium (Na), potassium (K), calcium (Ca), & magnesium (Mg). Ini membuka jalan bagi pemahaman tentang senyawa basa yg terkait dengan logam-logam tersebut.
- Pada tahun 1824, ahli kimia Prancis Joseph-Louis Gay-Lussac & Louis-Jacques Thénard berhasil mengisolasi natrium hidroksida (NaOH) dari natrium klorida (NaCl) dengan mereaksikannya dengan air.
- Pada tahun 1838, ahli kimia Jerman Justus von Liebig memperkenalkan istilah “alkali” untuk senyawa basa yg larut dalam air.
- Teori Asam-Basa:
- Pada tahun 1884, ahli kimia Denmark Svante Arrhenius mengembangkan teori disosiasi elektrolit, yg menjelaskan bahwa senyawa basa terdisosiasi menjadi ion hidroksida (OH-) dalam larutan.
- Pada tahun 1923, ahli kimia Denmark Johannes Brønsted & ahli kimia Inggris Thomas Lowry mengajukan teori asam-basa Brønsted-Lowry, yg mendefinisikan asam sebagai donor proton & basa sebagai akseptor proton.
- Abad ke-20:
- Pada tahun 1923, ahli kimia Amerika Gilbert N. Lewis mengembangkan teori asam-basa Lewis, yg mendefinisikan basa sebagai penerima pasangan elektron & asam sebagai donor pasangan elektron.
- Pada tahun 1938, ahli kimia Amerika Ralph Hultgren mengusulkan skala pH untuk mengukur tingkat keasaman maupun kebasaan suatu larutan. Skala pH digunakan secara luas dalam penentuan keasaman maupun kebasaan suatu senyawa.
- Pengembangan Senyawa Basa:
- Pada tahun 1950-an, industri kimia mulai mengembangkan senyawa basa yg lebih kuat & efisien. Contohnya merupakan pengembangan hidroksida logam alkali seperti natrium hidroksida (NaOH) yg digunakan dalam industri pulp & kertas, serta dalam produksi sabun.
- Pada tahun 1970-an, penemuan senyawa basa organik kuat, seperti n-butillitium (C4H9Li), memberikan kemajuan dalam sintesis senyawa organik kompleks.
- Abad ke-21:
- Pada saat ini, penelitian terus berlanjut untuk mengembangkan senyawa basa baru dengan sifat & aplikasi yg lebih unggul. Tujuan penelitian ini termasuk pengembangan senyawa basa yg lebih ramah lingkungan & efisien dalam berbagai reaksi kimia.
Sejarah senyawa basa itu nunjukkin banget gimana ilmu pengetahuan kita makin maju dalam ngertiin sifat-sifat zat ini.
Karakteristik Senyawa Basa
Ciri-ciri senyawa basa itu ada beberapa sifat dan perilaku yang bikin dia beda dari zat lain. Ini dia beberapa karakteristik utama basa:
- Kemampuan Menghasilkan Ion Hidroksida (OH-): Karakteristik paling khas dari senyawa basa merupakan kemampuannya untuk melepaskan ion hidroksida (OH-) saat terlarut dalam air. Ion hidroksida inilah yg memberikan sifat basa pada senyawa tersebut. Misalnya, natrium hidroksida (NaOH) terdisosiasi menjadi ion natrium (Na+) & ion hidroksida (OH-) dalam larutan.
- Rasa Pahit: Secara umum, senyawa basa mempunyai rasa pahit. Rasa pahit ini dapat dirasakan ketika senyawa basa terkena lidah maupun dikonsumsi. Namun, disarankan untuk tidak mencoba maupun mengonsumsi senyawa kimia tanpa pengetahuan & pengawasan yg memadai.
- Reaksi dengan Asam: Senyawa basa dapat bereaksi dengan asam dalam apa yg disebut reaksi netralisasi. Dalam reaksi ini, basa menerima proton (H+) dari asam, membentuk garam & air. Reaksi ini menghasilkan netralisasi keasaman & kebasaan.
- Perubahan Kertas Lakmus: Kertas lakmus merupakan indikator alami yg digunakan untuk menguji keasaman maupun kebasaan suatu larutan. Senyawa basa mempunyai sifat untuk mengubah kertas lakmus merah menjadi biru. Ini menunjukkan keberadaan ion hidroksida (OH-) yg meningkatkan pH larutan menjadi basa.
- Konduktivitas Listrik: Senyawa basa yg terlarut dalam air dapat menghasilkan ion hidroksida yg berperan dalam menghantarkan listrik. Oleh karena itu, larutan basa umumnya mempunyai konduktivitas listrik yg lebih tinggi dibandingkan dengan larutan netral maupun asam.
- Sifat Korosif: Beberapa senyawa basa, terutama hidroksida logam alkali, mempunyai sifat korosif maupun merusak. Mereka dapat mengiritasi kulit & jaringan tubuh serta mengakibatkan luka bakar pada kontak langsung.
- Pembentukan Garam: Ketika senyawa basa bereaksi dengan asam, mereka membentuk garam melalui reaksi netralisasi. Garam ini terbentuk melalui pertukaran ion antara basa & asam, dengan ion hidroksida (OH-) dari basa & ion hidrogen (H+) dari asam.
Eits, jangan buru-buru menyimpulkan! Ingat baik-baik, tidak semua senyawa yang punya 'gelar' hidroksida (OH-) atau menunjukkan sifat basa itu otomatis senyawa basa sejati. Ada juga yang bisa jadi netral, bahkan 'berkhianat' menjadi asam, semua tergantung pada bagian lain di molekulnya. Jadi, teliti sebelum percaya!
Nah, ciri-ciri ini bagaikan 'kartu identitas' yang super penting untuk mengenali dan mengelompokkan para senyawa basa, biar kita makin jago memahami sifat dan tingkah laku unik mereka!
Manfaat Senyawa Basa

Senyawa basa itu punya banyak banget manfaat penting di berbagai bidang. Ini dia beberapa kegunaan utamanya:
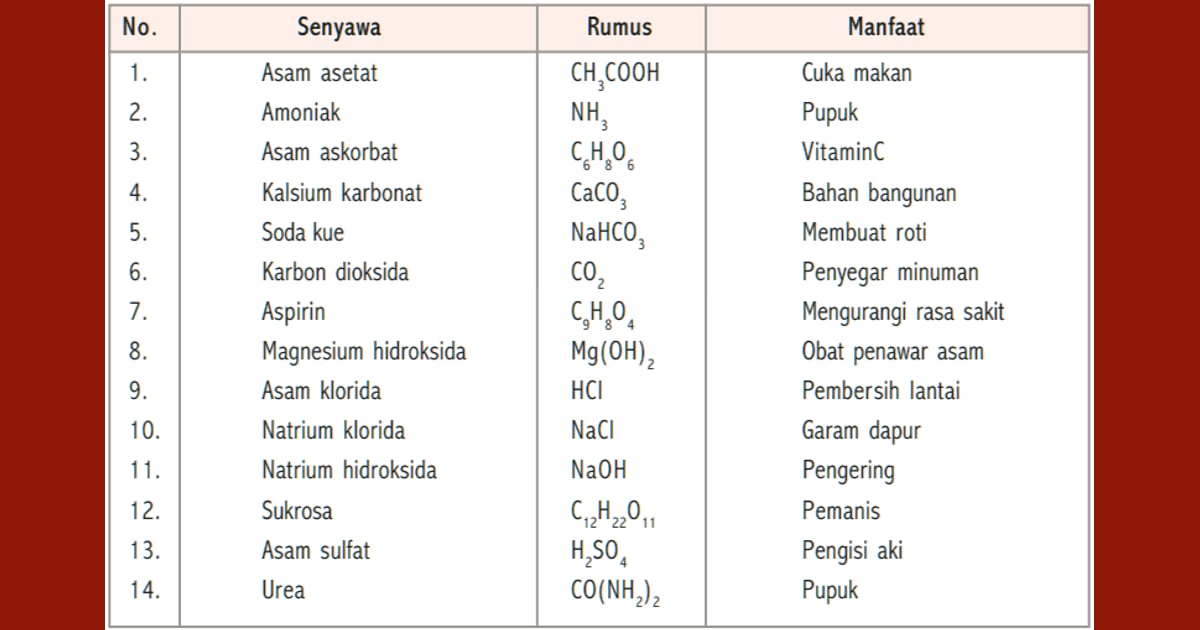
- Penggunaan dalam Industri Kimia: Senyawa basa digunakan secara luas dalam industri kimia untuk berbagai tujuan. Contohnya, natrium hidroksida (NaOH) digunakan dalam produksi sabun, pulp & kertas, produk pembersih, serta dalam pengolahan air & limbah. Senyawa basa juga digunakan dalam pembuatan bahan kimia lainnya, seperti pupuk & bahan kimia organik.
- Pengolahan Air & Limbah: Senyawa basa, seperti hidroksida logam alkali, digunakan dalam pengolahan air & limbah. Mereka dapat digunakan untuk menetralkan asam dalam air limbah industri, menghilangkan zat-zat berbahaya, serta mengendapkan logam berat yg terlarut dalam air.
- Industri Farmasi & Kesehatan: Beberapa senyawa basa digunakan dalam industri farmasi & kesehatan. Misalnya, senyawa basa seperti amonia digunakan dalam pembuatan obat-obatan, produk perawatan pribadi, & produk pembersih rumah tangga. Senyawa basa juga digunakan dalam proses sterilisasi & desinfeksi.
- Reaksi Kimia & Sintesis Organik: Senyawa basa mempunyai peran penting dalam berbagai reaksi kimia & sintesis organik. Mereka dapat digunakan sebagai agen penghilang asam, katalis, maupun bahan dasar dalam sintesis senyawa kompleks. Senyawa basa organik kuat, seperti n-butillitium (C4H9Li), digunakan dalam sintesis senyawa organik tingkat lanjut.
- Industri Metalurgi: Dalam industri metalurgi, senyawa basa digunakan dalam proses pelapisan logam, pengolahan bijih logam, & pemurnian logam. Misalnya, hidroksida logam alkali dapat digunakan dalam elektrolisis untuk mendapatkan logam murni dari bijih logam.
- Penggunaan dalam Laboratorium: Senyawa basa digunakan dalam berbagai eksperimen & analisis di laboratorium kimia. Mereka dapat digunakan untuk menyesuaikan pH larutan, menetralkan asam, maupun sebagai agen reagen dalam berbagai reaksi kimia.
- Aplikasi dalam Pertanian: Beberapa senyawa basa digunakan dalam pertanian, terutama sebagai pupuk. Senyawa basa seperti amonium hidroksida (NH4OH) maupun natrium hidroksida (NaOH) dapat digunakan untuk mengatur pH tanah & meningkatkan ketersediaan nutrisi bagi tanaman.
- Penggunaan dalam Industri Pangan: Senyawa basa tertentu, seperti natrium hidroksida (NaOH), dapat digunakan dalam industri pangan sebagai bahan pengatur pH, penghilang asam, maupun pengemulsi. Namun, penggunaannya harus diatur dengan hati-hati & sesuai dengan pedoman keamanan pangan.
Namun, ingat pesan ini baik-baik: dalam berinteraksi dengan senyawa basa, selalu kedepankan kehati-hatian dan patuhi semua aturan keamanan. Jangan sampai kejadian 'drama' di lab, ya!
Contoh Senyawa Basa
Ini dia beberapa contoh senyawa basa yang sering dipakai, lengkap sama rumus kimia dan sumber-sumber umumnya:
| Senyawa Basa | Rumus Kimia | Sumber Umum |
|---|---|---|
| Natrium Hidroksida | NaOH | Pembuatan Sabun, Pulp danamp; Kertas, Pengolahan Air & Limbah |
| Kalium Hidroksida | KOH | Industri Farmasi, Industri Kertas, Laboratorium |
| Amonium Hidroksida | NH4OH | Industri Farmasi, Laboratorium, Pembersih Rumah Tangga |
| Kalsium Hidroksida | Ca(OH)2 | Konstruksi, Pengolahan Air, Industri Makanan |
| Magnesium Hidroksida | Mg(OH)2 | Obat Kerasma, Suplemen Makanan |
| Aluminium Hidroksida | Al(OH)3 | Obat Antasid, Produk Kecantikan |
| Besi(II) Hidroksida | Fe(OH)2 | Pupuk, Industri Metalurgi |
| Besi(III) Hidroksida | Fe(OH)3 | Pencelupan Logam, Industri Cat |
| Natrium Karbonat | Na2CO3 | Pembuatan Kaca, Pembuatan Sabun |
| Amonium Karbonat | (NH4)2CO3 | Pembuatan Pewarna, Industri Pangan |
Tabel ini hanya mencakup beberapa contoh senyawa basa yg umum digunakan. Terdapat banyak senyawa basa lainnya dengan berbagai aplikasi & sifat yg berbeda.
Senyawa basa itu biasanya punya beberapa sifat, kayak rasanya pahit, bisa bikin kertas lakmus merah jadi biru, dan bisa netralin asam. Kalau basa bereaksi sama asam, mereka bakal bikin garam dan air lewat reaksi netralisasi. Oke, segitu dulu ya pembahasan kita kali ini!
Referensi
Ini dia beberapa sumber referensi yang bisa kamu pakai buat belajar lebih banyak tentang senyawa basa:
- Atkins, P., Overton, T., Rourke, J., Weller, M., Armstrong, F. “Shriver danamp; Atkins’ Inorganic Chemistry” (edisi ke-5). Oxford University Press, 2010.
- Chang, R. “Chemistry” (edisi ke-12). McGraw-Hill Education, 2015.
- Housecroft, C. E., Sharpe, A. G. “Inorganic Chemistry” (edisi ke-4). Pearson Education Limited, 2012.
- McMurry, J., Fay, R. C., Robinson, J. K. “Chemistry” (edisi ke-7). Pearson Education, Inc., 2014.
- Zumdahl, S. S., Zumdahl, S. A. “Chemistry: An Atoms First Approach” (edisi ke-2). Cengage Learning, 2016.
Pastikan kamu selalu melirik edisi paling gres dari buku-buku referensi, biar informasi yang didapat selalu 'nge-hits' dan paling mutakhir! Jangan lupa juga, jurnal ilmiah serta sumber online seperti artikel atau publikasi terbaru bisa jadi 'tambang emas' informasi yang sangat berharga.